Biomedizinische Analytik - Bachelorstudium
Gesundheit gestalten: Mensch, Medizin und Technik vereint.
Ihre Welt ist das Labor: Biomedizinische Analytiker*innen liefern der Medizin entscheidende Informationen zur Diagnose, Therapie und Therapieverlaufskontrolle. Dabei stehen ihnen hochtechnologische Werkzeuge zur Verfügung, deren Einsatz umfangreiches Wissen und Professionalität verlangen. Am Studiengang Biomedizinische Analytik haben beide Bereiche einen hohen Stellenwert – Studierende erhalten hier eine Ausbildung in einem Gesundheitsberuf mit hervorragenden Beschäftigungsaussichten in Österreich und der EU.
Interprofessionelles Studium Biomedizinische Analytik
Der Bachelor-Studiengang Biomedizinische Analytik zeichnet sich durch modern ausgestattete Laborplätze aus, die Studierende in Kleingruppen nutzen können. Hier lernen sie die Biomedizinische Analytik von der Pike auf: Wie man medizinische Proben untersucht, Labormesswerte ermittelt oder errechnet und der Zusammenhang von labordiagnostischen Ergebnissen und Krankheitsbildern hergestellt wird, zählt zu den Kernelementen des Studiums. Qualitätssicherung, Qualitätsmanagement, Risiko- und Prozessmanagement sind ebenfalls Themen, die im Rahmen der praktischen Ausbildung große Aufmerksamkeit genießen. Biomedizinische Analytik versteht sich als Praxisstudium, das eine berufliche Zukunft in der medizinischen Diagnostik, Forschung & Entwicklung oder Industrie ermöglicht.
Einen ersten Vorgeschmack darauf bekommen Biomedizinische Analytik Studierende in den studienbegleiteten Berufspraktika ab dem dritten Semester. Dabei lernen sie die Abläufe in hoch modernen medizinischen Laboratorien sowohl in Krankenanstalten als auch Instituten aus nächster Nähe kennen. Die Anforderungen in der medizinischen und naturwissenschaftlichen Forschung verändern sich rasant: Speziell durch den zunehmenden Einsatz von IT- und Automationstechnologie, der Biotechnologie und Gentechnologie, Stammzellforschung sowie Mikro-, Nano- und Chiptechnologien, aber auch andere Hochdurchsatztechnologien wie Massenspektrometrie bietet das Berufsfeld ständig neue Herausforderungen – die durch das innovative Curriculum des Studiengangs lückenlos abgedeckt werden.
Themen wie Molekulare Medizin, Pränataldiagnostik und Humangenetik finden darin ebenso Platz wie Funktionsdiagnostik, Biomedizinische Forschung und Life Sciences. Studierende befassen sich darüber hinaus mit den Bereichen medizinische Chemie, Immunologie und auch Blutuntersuchung – denn Biomedizinische Analytik findet nicht nur im Labor statt, sondern auch im direkten Kontakt mit den PatientInnen, etwa bei der Probenentnahme oder der Funktionsdiagnostik. Die Studierenden werden auch auf diese Tätigkeit bestens vorbereitet.
Online-Infosession buchen
In den Online-Infosessions stellt Ihnen die Programmleitung das Studium detailliert vor. Sie erhalten wertvolle Informationen zu Studieninhalt, Praktika, den Aufnahmevoraussetzungen und den vielfältigen Karrieremöglichkeiten.
FH-Prof. Dr. Marco Kachler, BSc LL.M.
Stellvertr. Studienbereichsleitung, Studiengangsleitung Biomedizinische Analytik
+43 5 90500 3530
m.kachler[at]fh-kaernten[dot]at
Biomedizinische Analytik - Infos
Ihre Ansprechpartnerinnen
Bei Fragen zum Studium kontaktieren Sie:
1. Zyklus (Bachelor)
180.00
€ 363,36 / Semester
- Bachelor of Science in Health Studies
6 Semester
€ 25,20 / Semester
Deutsch
- Klagenfurt
Allgemeine Studieninformationen
Profil - Biomedizinische Analytik
Biomedizinische Analytik ist ein interdisziplinäres Bachelorstudium im Spannungsfeld von Medizin, Technik und Naturwissenschaften. Absolvent*innen gelten als stark nachgefragte Fachkräfte in der medizinischen Laboratoriumsdiagnostik, in der biomedizinischen Forschung und Entwicklung, aber auch in bio- oder lebensmitteltechnologischer sowie pharmazeutischer Industrie. Das praxisnahe Studium bereitet auf selbstständige und eigenverantwortliche Ausführung aller Mess- und Untersuchungsmethoden in der Biomedizinischen Analytik sowie bei funktionsdiagnostischen Untersuchungen vor.
Dafür stehen modernste Laborarbeitsplätze zur Verfügung, an denen Studierende in Kleingruppen die wesentlichen Technologien, Verfahren und Methoden der Biomedizinischen Analytik erlernen. Vertieft werden diese praktischen Fähigkeiten in studienbegleiteten Berufspraktika, die ab dem dritten Semester Einblicke in das Arbeitsleben ermöglichen. Das Studium ermöglicht Tätigkeiten über mehrere Branchen hinweg – die alle auf professionelles Qualitäts-, Risiko- und Prozessmanagement setzen. Auch das wird im Studium Biomedizinische Analytik eingehend vermittelt.
Was Biomedizinische Analytik Studierende ins Studium mitbringen sollten:
- Interesse an Naturwissenschaften, Medizin und Technik.
- Offenheit für innovative Labortechnologien und automatisierte Untersuchungsverfahren und die Neugier daran, wie und wozu solche Verfahren angewendet werden.
- Die Fähigkeit, geduldig und mit Präzision zu arbeiten.
- Verantwortungsbewusstsein und Teamfähigkeit.
- Eine strukturierte, analytische und organisierte Herangehensweise an Aufgabenstellungen.
Nach erfolgreichem Abschluss des Studiums Biomedizinische Analytik verfügen Absolvent*innen über folgende Fähigkeiten und Kenntnisse:
- Sie führen Laboruntersuchungen an Körperflüssigkeiten, Geweben und Zellen selbstständig und in Eigenverantwortung durch und nehmen funktionsdiagnostische Untersuchungen vor.
- Sie liefern mit ihren Daten vor allem auf dem Gebiet der Human- und Veterinärmedizin entscheidende Grundlagen für die Diagnose, Therapie und Verlaufskontrolle von Krankheiten sowie für Vorsorge, Screening und Rehabilitation.
- Sie arbeiten insbesondere mit Materialen menschlichen oder tierischen Ursprungs und untersuchen vor allem Blut, Knochenmark, Harn, Stuhl, Gewebe, Fruchtwasser, Speichel und Haare.
- Sie verwenden dabei verschiedenste Laborgeräte und Laborverfahren, fertigen Gewebsschnitte an, begutachten mikroskopisch gefärbte Zellpräparate oder legen Zell- und Bakterienkulturen an.
Aktuelle Lehrveranstaltungen - Biomedizinische Analytik
| Lehrveranstaltung | Typ | SWS | ECTS-Credits | LV-Nummer |
|---|---|---|---|---|
| Berufspraktikum 4 | BOPR | 0,0 | 10,0 | B3.06651.60.700 |
| Data Science: Big Data und Bioinformatik | VÜ | 1,5 | 2,0 | B3.06651.60.660 |
| Integrative Biomedizinische Analytik, Trends und Entwicklungen einschl. Praxisreflexion und Forschungskolloquium Gruppe 1 | ILV | 2,5 | 10,0 | B3.06651.60.650 |
| Integrative Biomedizinische Analytik, Trends und Entwicklungen einschl. Praxisreflexion und Forschungskolloquium Gruppe 2 | ILV | 2,5 | 10,0 | B3.06651.60.650 |
| Integrative Biomedizinische Analytik, Trends und Entwicklungen einschl. Praxisreflexion und Forschungskolloquium Gruppe 3 | ILV | 2,5 | 10,0 | B3.06651.60.650 |
| Kommissionelle Bachelorprüfung | DP | 0,1 | 2,0 | BACPR |
| Organisationsentwicklung und Change Management | ILV | 1,0 | 1,0 | B3.00000.80.690 |
| Point of Care Diagnostic (POCT) | VO | 2,0 | 2,0 | B3.06651.60.680 |
| Qualitäts-, Risiko und Prozessmanagement in der biomedizinischen Analytik einschl. Labororganisation, Automation und Informationstechnologien | VO | 3,0 | 3,0 | B3.06651.60.670 |
| Lehrveranstaltung | Typ | SWS | ECTS-Credits | LV-Nummer |
|---|---|---|---|---|
| Analytik zum Screening, Vorsorge und Prävention, systemische und Stoffwechselerkrankungen, Fälle | VO | 3,0 | 3,0 | B3.06651.40.510 |
| Berufspraktikum 2 | BOPR | 0,0 | 12,0 | B3.06651.40.430 |
| Evidence-basiertes berufliches Handeln einschl. Praxisreflexion | ILV | 2,0 | 4,0 | B3.06651.40.520 |
| Gentechnologische Methoden und molekularbiologische Analyseverfahren | ILV | 2,0 | 2,0 | B3.06651.40.490 |
| Immunologie - Vertiefung | VO | 2,0 | 2,0 | B3.06651.40.480 |
| Kardiovaskuläre, pulmologische und neurophysiologische Funktionsdiagnostik | ILV | 4,0 | 4,0 | B3.06651.40.540 |
| Klientenzentrierte Kommunikation | ILV | 1,0 | 1,0 | B3.00000.80.530 |
| Zellbiologische Methoden und Zellkulturverfahren | ILV | 2,0 | 2,0 | B3.06651.40.500 |
| Freifach | Typ | SWS | ECTS-Credits | LV-Nummer |
| Gerinnungsanalytik - Koagulapathien (Fallbesprechungen) | UE | 1,0 | 1,0 | B3.06651.40.560 |
| Lehrveranstaltung | Typ | SWS | ECTS-Credits | LV-Nummer |
|---|---|---|---|---|
| Berufspraktikum 4 | BOPR | 0,0 | 10,0 | B3.06651.60.700 |
| Data Science: Big Data und Bioinformatik | VÜ | 1,5 | 2,0 | B3.06651.60.660 |
| Integrative Biomedizinische Analytik, Trends und Entwicklungen einschl. Praxisreflexion und Forschungskolloquium | ILV | 2,5 | 10,0 | B3.06651.60.650 |
| Kommissionelle Bachelorprüfung | DP | 0,1 | 2,0 | BACPR |
| Organisationsentwicklung und Change Management | ILV | 1,0 | 1,0 | B3.00000.80.690 |
| Point of Care Diagnostic (POCT) | VO | 2,0 | 2,0 | B3.06651.60.680 |
| Qualitäts-, Risiko und Prozessmanagement in der biomedizinischen Analytik einschl. Labororganisation, Automation und Informationstechnologien | VO | 3,0 | 3,0 | B3.06651.60.670 |
| Freifach | Typ | SWS | ECTS-Credits | LV-Nummer |
| Liquor- und Punktatdiagnostik, Harnsedimente (Repetitorium) | UE | 1,0 | 1,0 | B3.06651.60.710 |
| Lehrveranstaltung | Typ | SWS | ECTS-Credits | LV-Nummer |
|---|---|---|---|---|
| Anatomische und Physiologische Grundlagen | VO | 4,0 | 4,0 | B3.00000.70.110 |
| Chemische Grundlagen | VO | 3,0 | 4,0 | B3.06651.10.140 |
| Immunologische Grundlagen | VO | 2,0 | 2,0 | B3.06651.10.160 |
| Instrumentelle Analytik und Laboreinführung | ILV | 6,0 | 6,0 | B3.06651.10.180 |
| Medizinische Terminologie und Klassifikation | VÜ | 2,0 | 2,0 | B3.00000.70.100 |
| Mikroskopie und Morphologie 1 | ILV | 2,0 | 2,0 | B3.06651.10.170 |
| Mikroskopische Anatomie, Histologie und Zytologie | VO | 2,0 | 2,0 | B3.06651.10.120 |
| Spezielle Physiologie und medizinische Biochemie | VO | 2,0 | 2,0 | B3.06651.10.130 |
| Zeit- und Selbstmanagement | ILV | 1,5 | 2,0 | B3.00000.70.190 |
| Zell- und Molekularbiologische Grundlagen | VO | 3,0 | 4,0 | B3.06651.10.150 |
| Freifach | Typ | SWS | ECTS-Credits | LV-Nummer |
| Englisch-Basis | UE | 2,0 | 2,0 | B3.00000.70.200 |
| Erste Hilfe | UE | 1,0 | 1,0 | B3.00000.70.210 |
| Lehrveranstaltung | Typ | SWS | ECTS-Credits | LV-Nummer |
|---|---|---|---|---|
| Berufspraktikum 1 | BOPR | 0,0 | 6,0 | B3.06651.30.450 |
| Forschungsmethoden in den Bio- und Gesundheitswissenschaften | VO | 2,0 | 2,0 | B3.00000.70.430 |
| Hämatologischer Analyseprozess 2 | ILV | 3,0 | 3,0 | B3.06651.30.380 |
| Immunhämatologischer Analyseprozess | ILV | 3,0 | 3,0 | B3.06651.30.390 |
| Infektionshygienisches Monitoring | ILV | 3,0 | 3,0 | B3.06651.30.370 |
| Medizinisch-chemischer Analyseprozess 2 - Schwerpunkt spektrometrische, immunologische Analyseverfahren, Therapeutic Drug Monitoring | ILV | 4,0 | 4,0 | B3.06651.30.400 |
| Medizinische Biometrie und Epidemiologie | VO | 2,0 | 2,0 | B3.06651.30.440 |
| Molekularmedizinischer Analyseprozess | ILV | 2,0 | 2,0 | B3.06651.30.420 |
| Mykologischer, parasitologischer und virologischer Analyseprozess einschl. Infektionsserologie | ILV | 2,0 | 2,0 | B3.06651.30.360 |
| Organspezifische Störungsbilder, Fälle | VO | 2,0 | 3,0 | B3.06651.30.410 |
| Freifach | Typ | SWS | ECTS-Credits | LV-Nummer |
| Englisch - Work spheres | UE | 2,0 | 2,0 | B3.00000.70.460 |
| Krankenhaushygiene | UE | 1,0 | 1,0 | B3.06651.30.470 |
| Lehrveranstaltung | Typ | SWS | ECTS-Credits | LV-Nummer |
|---|---|---|---|---|
| Berufspraktikum 3 | BOPR | 0,0 | 17,0 | B3.06651.50.630 |
| Gesundheitsversorgung und Public Health | VO | 2,0 | 2,0 | B3.00000.70.580 |
| Humangenetik, Pränataldiagnostik, infektiologische und molekularmedizinische Störungsbilder (Fälle) | VO | 3,0 | 3,0 | B3.06651.50.570 |
| Integrative Biomedizinische Analytik, Projektstudium einschl. Praxisreflexion und Bachelorarbeitsbegleitseminar | ILV | 3,5 | 3,5 | B3.06651.50.620 |
| Nationale und internationale Qualitätssicherungskonzepte für die Biomedizinische Analytik, Gesundheitlicher Verbraucherschutz und Forensik | VO | 1,5 | 1,5 | B3.06651.50.610 |
| Professionalität und inter-, trans- und multiprofessionelle Zusammenarbeit | ILV | 1,5 | 1,5 | B3.06651.50.590 |
| Rechtliche Grundlagen für Gesundheitsberufe | VO | 1,5 | 1,5 | B3.00000.70.600 |
| Freifach | Typ | SWS | ECTS-Credits | LV-Nummer |
| Differenzierung von peripherem Blut und Knochenmark (Repetitorium) | UE | 1,0 | 1,0 | B3.06651.50.640 |
Beruf & Karriere - Biomedizinische/r Analytiker/in
Das FH-Studium Biomedizinische Analytik qualifiziert die Absolvent*innen für die selbstständige und eigenverantwortliche Durchführung aller Mess- und Untersuchungsmethoden in der Biomedizinischen Analytik sowie für die Durchführung von funktionsdiagnostischen Untersuchungen.
Die Biomedizinische Analytik Absolvent*innen haben die Möglichkeit, ihren Beruf in einem Dienstverhältnis zu einem Träger einer Krankenanstalt, einer Behörde, im ambulanten Bereich, in Wissenschaft und Forschung oder freiberuflich auszuüben.
Mehr Biomedizinische Analytik
Covid-19-Testungen am Studiengang Biomedizinische Analytik
Testlabor gemäß §28c Epidemiegesetz
PCR-Analytik SARS-CoV-2
(Referenzmethode RT-PCR)
Untersuchungsmaterial: Nasen- oder Rachenabstrich oder Gurgelatprobe
Express-Service (Einzeltestung)
Bearbeitungszeit: max. 45 Minuten
Preis/Person: 70,00 € (inkl. USt)
MO-FR: 09:00-15:00 Uhr
Standard-Service (Einzeltestung)
Bearbeitungszeit: In der Regel 3h
Preis/Person: 40,00 € (inkl. USt)
MO-FR: 07:30-08:00 Uhr
Unser Angebot umfasst folgende Laboruntersuchungen:
Die Leistungskomponenten PCR-Test umfassen die professionelle Entnahme eines Rachen- bzw. Nasenabstrichs durch die Mitarbeiter*innen des Studiengangs Biomedizinische Analytik bzw. die Entgegennahme eines Gurgelats, die Laboranalytik im hauseigenen Biomedizinischen Laboratorium sowie die elektronische Berichterstattung inkl. QR Code (immer in Deutsch, Englisch) an den/die Auftraggeber*in durch die Labormitarbeiter*innen. Die Leistungskomponenten der Serologietests (Antikörpertests) umfassen die
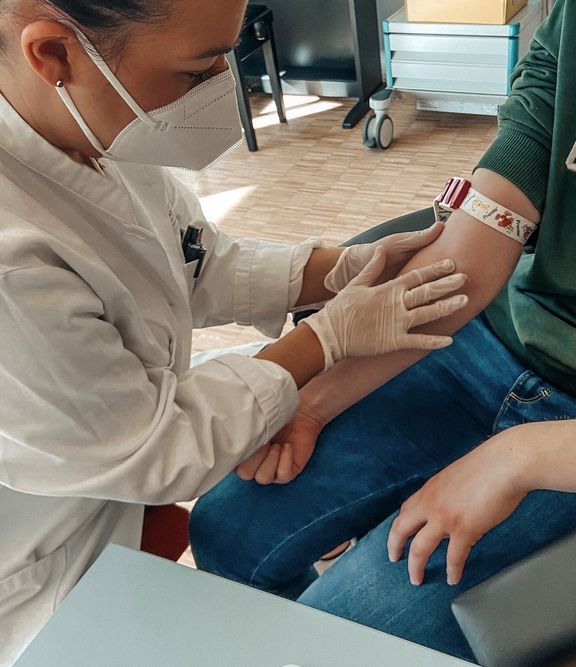
professionelle Entnahme einer venösen Blutprobe (5 mL) durch die Mitarbeiter*innen des Studiengangs Biomedizinische Analytik, die Laboranalytik im hauseigenen Biomedizinischen Laboratorium sowie die elektronische Berichterstattung an den/die Auftraggeber*in durch die Labormitarbeiter*innen.
Seit Februar 2022 bieten wir die Bestimmung von Antikörpern gegen SARS-CoV-2 auch aus Trockenblut an. Dazu haben wir Angebote mit unseren Kooperationsapotheken erarbeitet. Sprechen Sie uns gerne an, wer unsere Partnerapotheken sind.
Bitte buchen Sie Ihren gewünschten Termin in unserem Terminbuchungstool. Die Probenentnahme führen wir am FH-Campus St. Veiter Str. 47 in 9020 Klagenfurt durch. Bitte vergessen Sie nicht, einen Lichtbildausweis zur Identifikation mitzubringen.
FH KÄRNTEN
Campus Klagenfurt – St. Veiter Straße 47
Studiengang Biomedizinische Analytik
Covid-19-Testlabor:
+43 5 90 500 36 00 (Mo – Do 08:00 – 15:00 Uhr, Fr 08:00 – 12:00 Uhr)
testung[at]fh-kaernten[dot]at
Am Studiengang Biomedizinische Analytik unter der Leitung von FH-Professor Dr. rer. medic. Marco Kachler (Studiengangsleiter) und FH-Professorin Dr. rer. nat. Astrid Paulitsch- Fuchs (Molekular- und Mikrobiologin) wurde ein Covid-19-Testlabor an der FH Kärnten etabliert, das seit Mai 2020 nach §28c Epidemiegesetz behördlich zugelassen ist und seitdem Covid-19-Testungen durchführt. Die Covid-19-Testungen werden ausschließlich von wissenschaftlich qualifizierten Biomedizinischen Analytiker*innen und Naturwissenschaftler*innen am Studiengang durchgeführt und im Vieraugenprinzip fachlich validiert.
Unser Labor nimmt regelmäßig an Ringversuchen (externe Qualitätssicherung) teil, wodurch sichergestellt wird, dass wir die erforderliche Laborqualität erbringen.
Bei der PCR-Testung auf das Coronavirus SARS-Cov-2 (Covid-19) handelt es sich um einen direkten Nachweis von Virus-RNA aus menschlichem Zellmaterial gewonnen mittels eines Rachen- bzw. Nasenabstrichtupfers oder aus einer Gurgelatprobe. Um auch Virus-RNA vom jeweiligen Abnahmeutensil nachweisen zu können, ist eine ausreichende Menge an Zellmaterial abzustreichen. Je mehr Zellmaterial gewonnen wird, desto mehr Virus-RNA ist im Falle einer Infektion im Zellmaterial vorhanden, welches dann auch nachweisbar ist. Aus dem Zellmaterial werden im Labor unter Sicherheitsbedingungen die Virus-RNA isoliert und die Geninformation des Virus in einem molekularbiologischen Verfahren namens Real Time PCR detektiert. Weisen wir spezifisches Genmaterial vom Virus im Probenmaterial nach, so ist der Test positiv, d.h. es liegt eine Infektion mit SARS-Cov-2 vor. Erfolgt kein Nachweis von Virus-RNA ist der Test negativ (unter der Nachweisgrenze, kein CT-Wert). Unser Laborverfahren hat eine Nachweisgrenze von ca. 10 Virus-RNA-Partikel in der PCR. Für die PCR-Testung sind zwei Optionen verfügbar. Entweder die Entnahme der Proben direkt bei uns am FH-Campus durch unser professionelles Entnahmeteam der Biomedizinische Analytik bzw. Abgabe eines Gurgelats unter „Aufsicht“ oder die Einsendung der Abstrichproben (Oropharynx bzw. Nasopharyxn-Abstriche)/Gurgelats, die extern fachgerecht entnommen wurden (z.B. durch Ärzte/Ärztinnen, DGKP, Biomedizinische Analytiker*innen) ans Covid- 19-Testlabor.
Der PCR-Test ist jedoch nicht geeignet, um festzustellen, ob in der Vergangenheit eine SARS-Cov-2-Infektion durchgemacht wurde. Dafür haben wir einen immunologischen Test (ECLIA, ELISA) etabliert, der uns etwas darüber verrät, ob jemand bereits eine SARS-Cov-2- Infektion durchgemacht hat. Der Test ist auch verwendbar, um zu überprüfen, ob nach einer Covid-Immunisierung Antikörper gebildet wurden. Der Test erfasst auch die schützenden neutralisierenden Antikörper gegen SARS-CoV-2. Auch diese Untersuchung auf Antikörper gegen Covid-19 ist im Testlabor der FH Kärnten verfügbar.
Dafür muss eine kleine Menge Blut aus der Vene entnommen werden und die Serumprobe bei uns im Labor analysiert werden. Es besteht auch die Möglichkeit die Analyse aus Trockenblut durchzuführen, was sich vor allem bei Kindern aufgrund des kleineren Probenvolumens anbietet (Kapillarblutgewinnung aus der Fingerbeere).
Serologie SARS-CoV-2
Antikörper Anti-SARS-CoV-2 IgG (Spike-Protein)
Venöse Blutabnahme Bearbeitungszeit: max.5-7 Werktage
Preis/Person: € 38,00 (inkl. USt)
siehe Terminbuchung
Antikörper Anti-SARS-CoV-2 IgG (Spike-Protein)
Trockenblut
Bearbeitungszeit: max.5-7 Werktage
Preis/Person: € 30,00 (inkl. USt)
siehe Terminbuchung
Zur quantitativen Bestimmung von Antikörpern gegen SARS-CoV-2 verwenden wir standardmäßig einen automatisierten ELISA-Test des Herstellers Euroimmun. Das Analyseverfahren erfasst nach Angaben des Herstellers auch neutralisierende Antikörper, allerdings nicht ausschließlich. Es kann jedoch mit diesem Test nicht die biologische Wirkung der Antikörper zur Virusneutralisation überprüft werden.
Eine genauere Analyse auf das Vorhandensein neutralisierender Antikörper und deren Funktionalität ist mittels Neutralisationstest der Firma Euroimmun möglich. Dabei handelt es sich um einen Surrogat-Neutralisationstest gegen SARS-CoV-2, der sehr gut mit dem Referenztest des Virusneutralisationstests korreliert.
Nachweis: Ig-Gesamt Spike-Protein
Methode: ECLiA
Ergebnisdarstellung: Quantitativ* in BAU/mL Referenzintervall: < 0,8 BAU/mL (negativ)
Bewertung: <0,8 BAU/mL (negativ, nicht- reaktiv) | ≥0,8 -15 BAU/mL (grenzwertig) | >15 BAU/mL (reaktiv, positiv)
Nachweis: IgG Spike-Protein Methode: ELISA
Ergebnisdarstellung: Quantitativ* in BAU/mL
Referenzintervall: < 25,6 BAU/mL (negativ)
Bewertung: <25,6 BAU/mL (negativ, nicht- reaktiv) | ≥ 25.6 bis < 35,2 BAU/mL (grenzwertig) | ≥ 35,2 BAU/mL (positiv, reaktiv)
NEGATIV (nicht-reaktiv):
Sofern ein negatives Ergebnis vorliegt, wurden keine Antikörper gegen SARS-CoV-2 nachgewiesen. Entweder lag niemals ein Erregerkontakt mit SARS-CoV-2 vor oder der Erregerkontakt (Infektion) bzw. Impfung ist schon zu lange zurück liegend und die Immunantwort daher wieder negativ. Es ist daher davon auszugehen, dass keine Schutzwirkung vorliegt. In seltenen Fällen gibt es so genannte Non-Responder, Personen, bei denen keine oder eine nur sehr geringe Antikörperantwort ausgelöst wird. Ursachen einer solchen „Non-Response“ können beispielsweise eine medikamentöse Immunsuppression (z.B. Chemotherapie, Organtransplantation) bzw. Immunschwäche sein, kann aber auch angeborene Ursachen haben. Sollte der Verdacht vorliegen, empfiehlt sich ein T-Zell-Test.
Dabei wird die zelluläre Antwort überprüft, die ebenso wesentlich ist, wie die humorale Antwort (Antikörperbildung) und daher weitere wichtige Hinweise zur Klärung der Immunantwort gibt. Bitte wenden Sie sich in diesem Fall an unser Team.
GRENZWERTIG:
Sofern ein grenzwertiges Ergebnis vorliegt, wurden sehr geringe Antikörpermengen gegen SARS-CoV-2 nachgewiesen. Die vorliegende Antikörperantwort ist jedoch derart gering, das von keiner nennenswerten Schutzwirkung auszugehen ist. In seltenen Fällen gibt es so genannte Non-Responder, Personen, bei denen keine oder eine nur sehr geringe Antikörperantwort ausgelöst wird. Ursachen einer solchen „Non-Response“ können beispielsweise eine medikamentöse Immunsuppression (z.B. Chemotherapie, Organtransplantation) bzw. Immunschwäche sein, kann aber auch angeborene Ursachen haben. Sollte der Verdacht vorliegen, empfiehlt sich ein T-Zell-Test. Dabei wird die zelluläre Antwort überprüft, die ebenso wesentlich ist, wie die humorale Antwort (Antikörperbildung) und daher weitere wichtige Hinweise zur Klärung der Immunantwort gibt. Bitte wenden Sie sich in diesem Fall an unser Team.
POSITIV (reaktiv):
Sofern ein positives bzw. reaktives Ergebnis vorliegt, wurden Antikörper gegen SARS-CoV-2 nachgewiesen. Aufgrund von wissenschaftlichen Untersuchungen wird versucht herauszufinden, wie sich die Schutzwirkung aufgrund einer durchgemachten Infektion bzw. eines abgeschlossenen Impfzyklus gegen Infektion bzw. Neuinfektion mittels SARS-CoV-2 verhält. Eine beachtliche Studie von Dimeglio et al. (2021) kommt zu folgenden Erkenntnissen zur Beurteilung der Antikörpertiter in Bezug auf die Einschätzung einer Schutzwirkung. Dabei betrug die Schutzwirkung bei Antikörpertitern zwischen 13 und 141 BAU/mL nur 12%, bei Antikörpertitern zwischen 141 und 1700 BAU/mL immerhin 89,3% und einen Vollschutz (100%) bei Antikörpertitern >1700 BAU/mL. Allerdings muss man einschränkend feststellen, dass sich diese Ergebnisse auf die Wildtypvirusinfektion und Infektionen mittels bis Mai 2021 zirkulierender Virusvarianten beschränken. Zur aktuellen Virusvariante Omikron gibt es bisher noch keine neuen validen Erkenntnisse bezüglich der Schutzwirkung und der Antikörperhöhe.
Trotz Vorliegen eines positiven Test auf Antikörper sind weiterhin Vorsichtsmaßnahmen geboten, um die Ausbreitung von SARS-CoV-2 zu minimieren. Bei entsprechender klin. Symptomatik oder sonstigem Verdacht auf eine aktive Infektion empfiehlt sich zur Abklärung der Infektiosität die Durchführung eines SARS-CoV-2 RT PCR Tests.
Nachweis: Nucleocapsid Protein
Methode: ELISA
Ergebnisdarstellung: Semiquantitativ* in Ratio Bewertung: <0,8 (negativ, nicht- reaktiv) | ≥ 0,8 bis < 1,1 (grenzwertig) | ≥ 1,1 (positiv, reaktiv)
Für eine sichere Aussage, ob ausreichend schützende neutralisierende Antikörper gegen SARS- CoV-2 (z.B. nach einer Impfung oder COVID-Erkrankung) vorliegen, kann der so genannte Neutralisationstest Erkenntnisse liefern, da durch diesen Test ausschließlich diese neutralisierenden Antikörper erfasst werden. Der Neutralisationstest gibt also Aufschluss über die tatsächliche Neutralisationskapazität, d.h. es wird festgestellt, ob tatsächlich eine biologische Neutralisation durch die vorliegenden Antikörper erfolgen kann. Darüber hinaus erfasst der Neutralisationstest auch die Wirkung gegenüber den wichtigsten Virusmutanten im Spike-Protein. Mittels SARS-CoV-2-NeutraLISA kann die inhibitorische Wirkung von Antikörpern gegen SARS-CoV-2 nachgewiesen werden. Es wird die Interaktion der biochemisch gebildeten Rezeptorbindungsdomäne und dem Angiotensin-konvertierendes Enzym 2 (ACE2) detektiert.
Nachweis: Neutralisierende Antikörper
Methode: ELISA
Ergebnisdarstellung: Qualitativ (negativ, grenzwertig, positiv) Referenzintervall: <20% (negativ) Bewertung: %IH < 20 (negativ) | %IH ≥ 20 bis < 35 (grenzwertig) | %IH ≥ 35 (positiv)
Beurteilung der Ergebnisse des qualitativen Neutralisationstests (NAb)
NEGATIV
Sofern ein negatives Ergebnis (<20% IH) vorliegt, wurden keine neutralisierende Antikörper (NAb) gegen SARS-CoV-2 nachgewiesen. Entweder lag niemals ein Erregerkontakt mit SARS-CoV-2 vor oder der Erregerkontakt (Infektion) bzw. Impfung ist schon zu lange zurück liegend und die Immunantwort daher wieder negativ. Es ist daher davon auszugehen, dass keine Schutzwirkung vorliegt.
GRENZWERTIG
Sofern ein grenzwertiges Ergebnis (20 bis 35% IH) vorliegt, wurden sehr geringe Antikörpermengen von neutralisierenden Antikörpern (NAb) gegen SARS-CoV-2 nachgewiesen. Die vorliegende Antikörperantwort ist jedoch derart gering, das von keiner nennenswerten Schutzwirkung auszugehen ist.
POSITIV (reaktiv)
Sofern ein positives Ergebnis (> 35% IH) vorliegt, wurden neutralisierende Antikörper (NAb) gegen SARS-CoV-2 nachgewiesen.
Trotz Vorliegen eines positiven Antikörpertests sind weiterhin Vorsichtsmaßnahmen geboten, um die Ausbreitung von SARS-CoV-2 zu minimieren. Bei entsprechender klinischer Symptomatik oder sonstigem Verdacht auf eine aktive Infektion empfiehlt sich zur Abklärung der Infektiosität die Durchführung eines SARS-CoV-2 RT PCR Tests.
Nachweis: Interferon Gamma Konzentration Methode: IGRA
Ergebnisdarstellung: Quantitativ in mIE/ml
Referenzintervall: <100 mIE/ml (negativ, nicht reaktiv)) | ≥ 100 bis < 200 (grenzwertig) | ≥ 200 (positiv, reaktiv)
Für die Trockenblutanalyse (Dried Blood Spots, DBS) wird Kapillarblut aus der Fingerbeere entnommen und auf eine Blutabnahmekarte aufgetragen. Dieses Verfahren zeichnet sich durch das geringe Probenvolumen aus. Das Probenmaterial kann für den quantitativen Anti- SARS-CoV QuantiVac ELISA (IgG) verwendet werden. Dieses Analyseverfahren ist mit der venösen Blutabnahme vergleichbar und besonders geeignet, wenn die venöse Blutentnahme nicht gewünscht wird.
Unser Labor nimmt regelmäßig an Ringversuchen (externe Qualitätssicherung) teil, wodurch sichergestellt wird, dass wir die erforderliche Laborqualität erbringen. Wir sind gesetzlich verpflichtet, mindestens einmal im Jahr einen Ringversuch für die COVID-RT-PCR durchzuführen. An den anderen Ringversuchen nehmen wir aufgrund unserer Qualitätspolitik freiwillig teil.
Terminbuchung
Statements
Mitarbeiter*innen - Biomedizinische Analytik
FH-Prof. Dr.
Marco Kachler, BSc LL.M.
m.kachler[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Anja Drabosenig
a.drabosenig[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Diana Holbura, BA MA MHC
d.holbura[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Lisa Krenn
lisa.krenn[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Mag. rer. soc. oec.
Daniela Reautschnig
d.reautschnig[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Tamara Stotter, BA
t.stotter[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Ines Tanja Grud, BA MSc
FH-Prof. Mag.a Dr.in
Astrid Paulitsch-Fuchs
a.paulitsch-fuchs[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Elisabeth Mara, B.Sc. M.Sc. Ph.D.
Manuel Wiester, BSc M.Sc.
m.wiester[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Rudolf Janz, M.Ed.
Viktoria Scariano, BSc MSc
v.scariano[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
FH-Prof.in Priv.-Doz. Mag.a Dr.in
Eva Mir
Mag.a Dr.in rer. nat.
Tanja Oberwinkler-Sonnleitner, MSc
t.oberwinkler-sonnleitner[at]fh-kaernten[dot]at
Primoschgasse 10
9020 Klagenfurt am Wörthersee
Valentina Percher, BSc
v.percher[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Nina Lackner, Ph.D.
n.lackner2[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Rudolf Markt, MSc
Mag.
Andreas Gamnig
Dott. mag.
Paolo Scariano
p.scariano[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Claudia Bodner
Dr.in med. univ.
Carina Brenner, BSc
Dipl.-Biol. Dr.
Martin Christmann
Mag.sc.hum.
Elisabeth Fedl, M.Ed.
Helga Flamm, MA
Mag. (FH) Dr.
Doris Anna Gebhard
Prof. DDr.
Norbert Gässler
Dr.
Martin Hyden
Peter Jakosch, BSc
Dr.in
Sylvia Kaap-Fröhlich
Stephanie Kayser
Michael Koller, BSc MSc
Andrea Michelsen, MSc.
Christiane Peine
Dr.in
Julia Poland
Mag.
Rolf Reiterer
Anna Rieder, BSc M.Sc.
Dr.
Folker Spitzenberger
Jasmin Zaunschirm-Strutz, BSc MSc
j.zaunschirm-strutz[at]fh-kaernten[dot]at
St. Veiterstraße 47
9020 Klagenfurt am Wörthersee
Campus
Campus Klagenfurt–St. Veiter Straße
Die Kärntner Landeshauptstadt verfügt das ganze Jahr über zahlreiche Veranstaltungen und Sehenswürdigkeiten. Egal ob das World Bodypainting Festival, Ironman Austria, Großkonzerte im Wörtherseestadion, Open Air Kino im Burghof oder der zauberhafte Christkindlmarkt im Advent - bei uns ist immer was los.
Kurze Wege zeichnen den Campus in der St. Veiter Straße in Klagenfurt aus. Das FH-Gebäude befindet sich in unmittelbarer Nähe des Stadtkerns und liegt direkt am Klinikum-Gelände. Zudem ermöglichen Grünflächen ein angenehmes Verweilen an der Hochschule.
Erkunden Sie den Campus Klagenfurt–St. Veiter Straße und das Ärztehaus bei einer 360° Tour.
Von Villach oder Wolfsberg kommend: Sie fahren auf der Südautobahn A 2 , Umfahrung Klagenfurt Nord und wählen Sie die Ausfahrt Klagenfurt Nord/ Feldkirchen. Fahren Sie auf der Feldkirchner-Straße nach Süden - Richtung Stadt. Folgen Sie dem Straßenverlauf bis zum St. Veiter Ring und biegen Sie links ab. Fahren Sie bei der Kreuzung St. Veiter Straße nach links und wählen Sie nach ca. 600 m die Einfahrt zum Gelände des Landeskrankenhauses auf der linken Seite. Unser Hochschulgebäude befindet sich auf der linken Seite.
Von St. Veit kommend: Sie kommen von der S37 direkt auf die St. Veiter Straße. Folgen Sie dem Straßenverlauf bis zur Einfahrt ins Gelände des Landeskrankenhauses auf der rechten Seite. Unser Hochschulgebäude befindet sich auf der linken Seite.
Vom Hauptbahnhof Klagenfurt kommend: Wenn Sie aus dem Bahnhofsgebäude kommen gehen Sie links Richtung Busbahnhof. Die Linien 40 und 41 der Stadtwerke Klagenfurt bringen Sie zu unserem Gebäude. Distanz: ca. 2,5 km. Gehzeit: ca. 25 Minuten.
Vom BusbahnhofHeiligengeistplatz kommend: Die Linien 40 & 41 der Stadtwerke Klagenfurt bringen Sie zu uns. Distanz: ca. 1,2 km.
Gehen Sie zu Fuß - entdecken Sie die Stadt!
Vom Busbahnhof - Heiligengeistplatz kommend: Gehen Sie nach Osten auf der Wiesbadener-Str. Richtung Neuer Platz und halten Sie sich rechts. Biegen Sie links in die Kramergasse ab, queren den Alten Platz und gehen weiter in der Wiener Gasse bis zum Heuplatz. Überqueren Sie den Heuplatz und gehen Sie weiter auf der St. Veiter Straße, nach ca. 600 m ist an der linken Seite der Eingang zum Gelände des Landeskrankenhauses Klagenfurt. Unser Gebäude befindet sich an der linken Straßenseite. Gehzeit: ca. 15 Min.
Am Lageplan des Landeskrankenhauses Klagenfurt hat unser Gebäude die Nummer 24.
Kontakt
St. Veiter Straße 47
9020 Klagenfurt, Austria
+43 5 90500 3501
gesundheit-und-soziales[at]fh-kaernten[dot]at
Erkunden Sie den Campus Klagenfurt–St. Veiter Straße bei einer 360° Tour.


























